Quando la macchina si ferma: come riparare il nostro principale mezzo di locomozione, il muscolo scheletrico
di Alessandra Castiglioni
Esercizio 1 Prelettura.
- Lettura del testo Quando la macchina si ferma: come riparare il nostro principale mezzo di locomozione, il muscolo elettrico.
- 1. Leggi solo il titolo e cerca di individuare se il testo parla di
- 2. Hai sentito parlare della distrofia muscolare di Duchenne?
- 3. Se la tua risposta è SI descrivi brevemente che cos’è:
- 4. Se la tua risposta è NO cerca la risposta nei seguenti indirizzi e scrivi sotto che cos’è:
https://it.wikipedia.org/wiki/Distrofia_di_Duchenne
http://www.my-personaltrainer.it/salute-benessere/distrofia-muscolare-duchenne.html
•La distrofia di Duchenne è la più frequente e la meglio conosciuta tra le distrofie muscolari dell'infanzia. Ha un decorso relativamente rapido e attivo. Essa è anche detta distrofia muscolare generalizzata dell'infanzia.
•La distrofia muscolare di Duchenne (DMD) è una patologia genetica, talvolta a carattere ereditario, che colpisce i muscoli. I pazienti perdono il tono muscolare, per l'assenza di un proteina fondamentale: la distrofina. In pochi anni, l'interessamento dei muscoli è totale, tanto che i malati sono costretti alla sedia a rotelle e a una respirazione assistita.
•La distrofia muscolare di Duchenne (DMD) è una malattia genetica ereditaria che indebolisce i muscoli del corpo, deputati al movimento. In medicina, tale indebolimento muscolare è detto ipostenia.
ATTENZIONE:
Gli esercizi della preelettura ti avranno già indicato che il tema principale del testo è fare l’ analisi delle principali caratteristiche dei muscoli del corpo umano concentrandoci sul muscolo scheletrico ed i problemi provocati da una disfunzione di esso.
Ci sono tre tipi di muscoli, quello scheletrico e dobbiamo segnare anche quello liscio e quello cardiaco; il tessuto muscolare scheletrico è il più abbondante, e in un uomo adulto costituisce circa il 40% del peso corporeo. Come suggerisce il nome stesso, il muscolo scheletrico è collegato alle ossa; il suo movimento di contrazione e rilassamento fa sì che i segmenti ossei in cui si inserisce modifichino la reciproca posizione.
Il muscolo scheletrico si costituisce con i seguenti elementi:
- Acqua (circa il 75%).
- Proteine (circa il 20%). Le più importanti sono la miosina e l'actina.
- Glicidi (0,5-1,5%). Il più importante è il glicogeno.
- Grassi neutri, colesterolo e fosfolipidi.
- Sali minerali (circa il 5%).
- Enzimi.
- Sostanze estrattive azotate (es.: creatina e urea) e sostanze estrattive non azotate (es.: acido lattico).
- Pigmenti (es: la mioglobina)
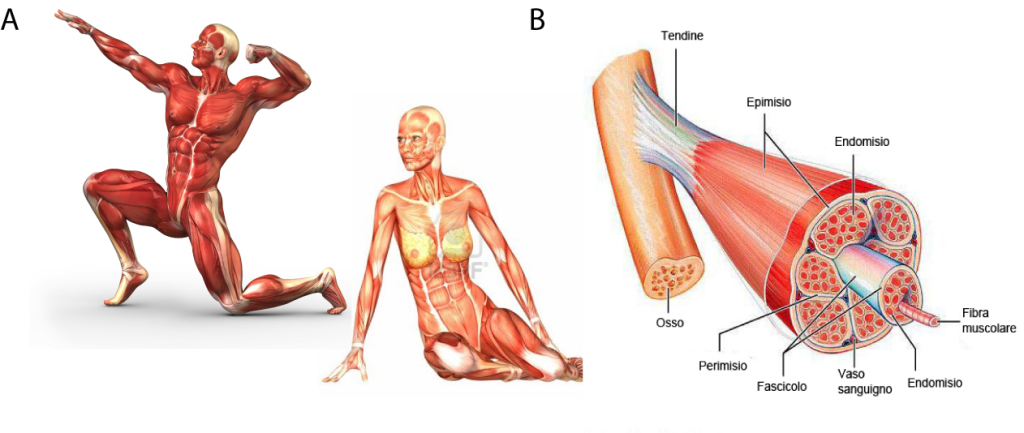
Il nostro potente mezzo di locomozione, il muscolo scheletrico, ha grandi capacità rigenerative, che però non funzionano adeguatamente in pazienti affetti da distrofia muscolare. Negli ultimi anni la ricerca scientifica ha fatto passi da gigante nel campo dell’ingegneria genetica offrendo la speranza di una cura per le migliaia di persone affette da distrofia muscolare di Duchenne.
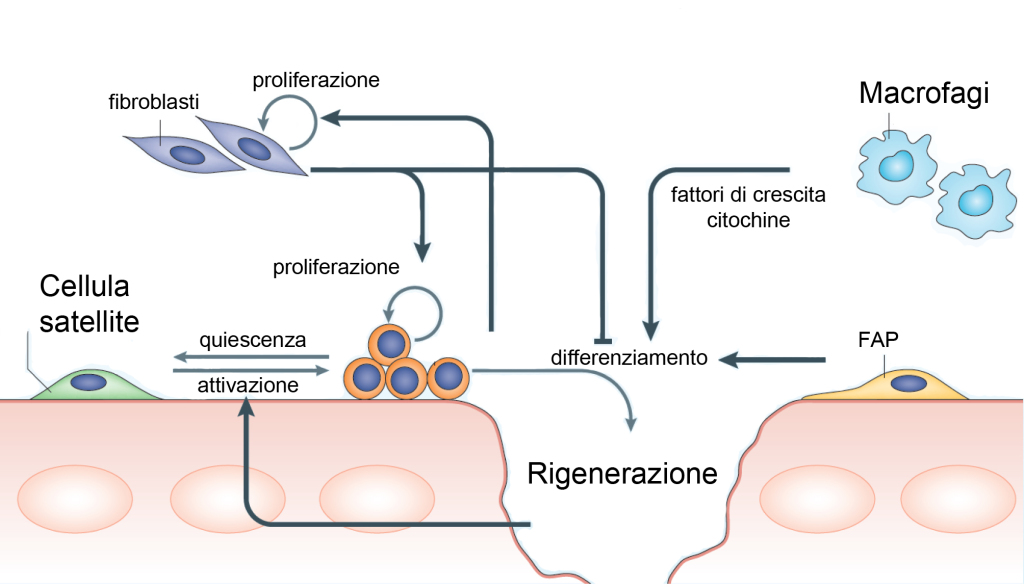
Raramente capita di pensarci, ma il nostro corpo è dotato di un’eccezionale capacità: il movimento. Dobbiamo questa nostra abilità a un tessuto molto speciale che si chiama muscolo scheletrico. Il muscolo scheletrico è il tessuto più abbondante del nostro corpo costituendo il 40% del peso corporeo negli uomini e il 30% nelle donne [1]. Esso è costituito da fasci di fibre muscolari che a loro volta sono costituite da fasci di miofibrille, le quali contengono migliaia di unità contrattili che sono in grado di contrarsi e generare forza (figura 12). Grazie alla loro struttura organizzata, i nostri muscoli ci permettono di compiere movimenti eccezionali, come quelli di un atleta in una gara di ginnastica, e movimenti precisi, come quelli della mano di un mastro orologiaio, ma sono responsabili anche dei movimenti più banali, che diamo per scontati, come il bere un bicchiere d’acqua e stare in piedi sull’attenti. Forse non tutti sanno che i muscoli scheletrici hanno anche un’altra proprietà eccezionale: sono in grado di ripararsi e rigenerarsi in seguito ad un danno. Il meccanismo tramite il quale il muscolo scheletrico è in grado di rigenerarsi è molto complesso, ma grazie ad anni di ricerche e studi su modelli animali, oggi sappiamo che almeno due componenti cellulari sono necessarie perché il processo funzioni correttamente: le cellule satelliti e i macrofagi [2-3]. Le prime sono le cellule staminali residenti del muscolo. Esse sono cellule quiescenti, molto rare, posizionate alla periferia delle fibre muscolari che in seguito ad un danno (che può essere indotto anche solo dall’esercizio fisico) si attivano. In seguito all’attivazione possono dare origine a due tipi di cellule figlie: una cellula figlia prolifererà, differenzierà e fondendosi darà origine a nuove fibre muscolari; la seconda cellula figlia invece tornerà in stato di quiescenza, mantenendo così costante il numero di cellule staminali presente nel tessuto. I macrofagi sono invece cellule del sistema immunitario che vengono richiamate in sede di danno e hanno un compito duplice: in primis quello di fagocitare i detriti che possono essersi formati creando quindi spazio per le nuove cellule e, in secundis, quello di produrre una serie di fattori che facilitano il differenziamento delle cellule satelliti (figura 13). Quando questo processo funziona correttamente, il danno viene riparato, nuovo tessuto muscolare viene creato e il muscolo torna a funzionare in maniera corretta. Quando questo meccanismo di riparo non funziona in maniera adeguata si assiste ad un fenomeno di perdita di tessuto muscolare in cui molto spesso al posto di muscolo si creano tessuto fibrotico e/o tessuto adiposo. Perdendo la sua normale struttura, il tessuto perde le sue capacità contrattili e di generare forza con il risultato che il soggetto affetto da queste condizioni gradualmente perde la capacità di muoversi. Tutti abbiamo in mente esempi di persone colpite da malattie neuromuscolari, ma la perdita di tessuto muscolare è associata anche ad altre condizioni patologiche come in pazienti affetti da cancro o da AIDS, e in generale questo fenomeno è comune nelle persone anziane. Ognuna di queste condizioni in cui si assiste a una perdita di tessuto muscolare ha una causa differente che può essere più o meno complessa. La perdita di muscolo legata all’invecchiamento per esempio può essere causata dal fatto che le cellule satelliti perdono la loro capacità di rigenerarsi riducendosi così in numero. Allo stesso tempo con l’invecchiamento si assiste ad un generale aumento dell’infiammazione che, dato il ruolo del sistema immunitario nella rigenerazione muscolare, potrebbe a sua volta influenzare la capacità del muscolo di ripararsi. Non sappiamo ancora esattamente quale sia il meccanismo per cui invecchiando perdiamo massa muscolare, ma è un argomento in auge nel mondo della medicina rigenerativa e probabilmente in futuro ne avremo un’idea più precisa che ci porterà ad essere in grado di rallentare questo processo migliorando la qualità della vita delle persone anziane. Sappiamo qualcosa di più riguardo ad alcune malattie genetiche che colpiscono l’apparato muscolo scheletrico: le distrofie muscolari. Queste sono un gruppo di malattie genetiche caratterizzate appunto da debolezza muscolare progressiva e atrofia (perdita di tessuto muscolare). Esistono diverse distrofie muscolari ognuna legata alla mutazione di un gene differente. Solitamente i geni coinvolti codificano per proteine importanti per la struttura muscolare.

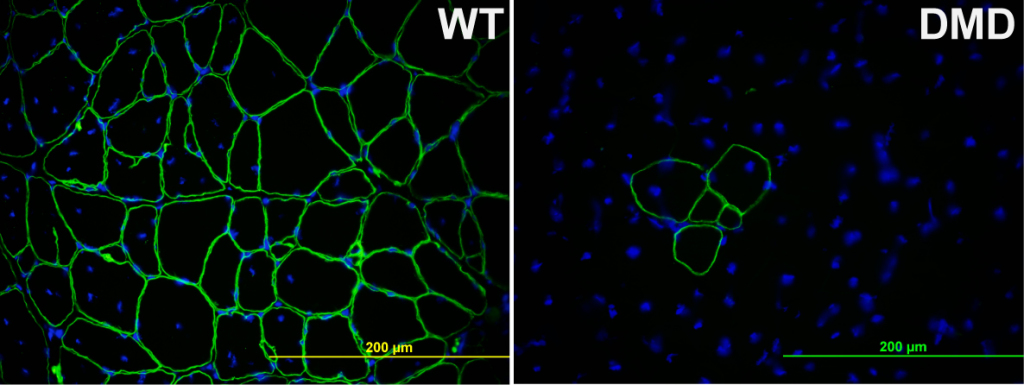
È questo per esempio il caso della distrofia muscolare più diffusa: la distrofia muscolare di Duchenne (Duschenne Muscular Dystrophy, DMD). La DMD ha un’incidenza di 1 su 3500 nati maschi. Questo significa che in Italia ogni anno nascono circa 70 bambini affetti da DMD. Poiché la DMD è causata da mutazioni nel gene della Distrofina che si trova sul cromosoma X, solitamente colpisce i maschi e solo raramente le femmine, che sono però portatrici delle mutazioni. Due terzi dei casi sono familiari, ma i restanti sono dovuti a mutazioni sporadiche (in Italia quindi 23 casi su 70 si verificano in famiglie senza alcuna storia di DMD). La distrofina è una proteina importante per il mantenimento della struttura del citoscheletro delle fibre muscolari. Se assente, la contrazione muscolare provoca la rottura della membrana muscolare con conseguente danno. I pazienti affetti da DMD vanno quindi incontro a continui cicli di danno e rigenerazione, con conseguente attivazione continua delle cellule satelliti e infiammazione cronica del tessuto muscolare. Con il passare degli anni, le cellule satelliti si esauriscono e il tessuto diventa fibrotico. I bambini affetti da DMD sono diagnosticati a 3-5 anni d’età, a 12 perdono l’uso delle gambe e solitamente muoiono per insufficienza respiratoria o cardiaca intorno ai 25-30 anni. Non esistono terapie in grado di curare questa malattia. I trattamenti disponibili al momento hanno il solo scopo di tenere sotto controllo i sintomi e l’infiammazione, senza impedire l’inevitabile avanzamento della malattia. Si sta lavorando quindi per trovare una terapia che vada a correggere la causa della DMD. La sfida sta nel trovare un modo di ripristinare l’espressione della distrofina in tutti i muscoli del corpo in modo permanente. Esistono diversi approcci che includono la messa a punto di terapie cellulari, terapie genetiche e la ricerca di molecole in grado di bypassare il difetto genetico.
Nel caso delle terapie cellulari l’obiettivo di alcune ricerche è quello di sostituire le cellule satelliti portatrici della mutazione con cellule derivanti da donatore sano. Purtroppo questa strada appare molto difficile perché queste cellule sono rare, non hanno grandi capacità di migrazione, e una volta messe in cultura per aumentarne il numero, perdono le loro proprietà staminali. Negli ultimi anni la generazione di iPS cells (vedi Box 1) sembra poter essere la soluzione di alcuni di questi problemi: la possibilità di generare in vitro cellule staminali a partire dalle cellule adulte del paziente stesso provvederebbe una fonte inesauribile di cellule che possono essere corrette geneticamente in vitro e iniettate nel paziente all’infinito, risolvendo anche il problema del rigetto immunologico.
Al momento la sfida più importante che i sostenitori di questo approccio devono vincere riguarda l’ottenimento di un protocollo robusto e affidabile che possa trasformare le iPSC in cellule simili alle cellule satelliti.
iPS CELLS
Induced pluripotent stem cells (iPSC) sono cellule adulte che sono state modificate geneticamente per tornare ad uno stato simile a cellule staminali embrionali. Avendo proprietà simili a quelle di cellule staminali embrionali esse sono in teoria in grado di dare origine a qualunque tipo cellulare.
Altri gruppi di ricerca si stanno concentrando sul trovare un modo di correggere il difetto genetico senza ricorrere alla terapia cellulare introducendo direttamente nel paziente degli enzimi in grado di modificare in modo specifico il genoma. In questo senso sono stati fatti passi da gigante nel campo della genetica molecolare [4] e oggi questa strada appare più che percorribile. Rimane il problema di come fare arrivare in modo efficace questi enzimi nel tessuto muscolare e c’è grande competizione tra vari gruppi di ricerca per arrivare alla soluzione il più presto possibile.
Circa il 10-15% dei casi di DMD sono causati da mutazioni che introducendo un segnale di stop impediscono la produzione di distrofina. Alcuni farmaci sono in grado di interferire con la produzione di proteine (inclusa la distrofina) in modo da ignorare questo segnale e permettere alla cellula di produrre la suddetta proteina. Nonostante questo sia un approccio molto promettente, i primi studi nell’uomo non hanno dimostrato l’efficacia che si sperava e siamo ancora lontani dall’avere un farmaco che soddisfi sia i criteri di sicurezza che di efficacia [5].
Approssimativamente l’80% delle mutazioni che causano la DMD può essere corretto grazie alla modifica del processo di editing dell’mRNA evitando l’esone mutato (il così detto “exon skipping”, vedi Box 2). Alcuni particolari oligonucleotidi antisenso (antisense oligonucleotides, AONs) ibridizzandosi a sequenze complementari adiacenti all’esone target, possono modulare lo splicing e ristabilire una lettura corretta da parte della macchina traduzionale, permettendo l’espressione di una versione troncata, ma funzionale della proteina. I ricercatori in questo caso si sono ispirati all’osservazione di ciò che avviene in natura: nei modelli distrofici in cui non c’è alcuna produzione della proteina, si possono trovare alcune fibre muscolari positive per distrofina, chiamate fibre revertanti, nelle quali questo splicing alternativo avviene naturalmente (figura 14). Purtroppo le due sperimentazioni cliniche in corso (Drisapersen, Prosensa-GSK e Eteplirsen, Sarepta Therapeutics) nonostante stiano dimostrando che in principio questa strategia funziona, non stanno dando risultati soddisfacenti in termini di efficacia.
SPLICING ed EXON SKIPPING
Nel DNA di ogni cellula sono contenute le informazioni per costruire tutte le proteine necessarie alla vita e alla funzione della stessa. Ogni proteina è codificata da un gene (DNA) che è trascritto in un RNA messaggero che a sua volta sarà tradotto in una proteina. Nel passaggio di trascrizione (DNA–>RNA) avviene il cosiddetto “splicing”: alcuni tratti del gene (chiamati introni) vengono eliminati, mentre i rimanenti tratti (esoni) vengono legati insieme per formare la forma matura dell’RNA messaggero. L’RNA messaggero contiene un codice fatto di triplette di nucleotidi (le unità di base di DNA e RNA) che vengono tradotti nelle unità di base delle proteine (amminoacidi). Questo codice contiene anche segnali di STOP che indicano quando il processo di creazione della proteina deve fermarsi. Alcune mutazioni creano segnali di STOP sbagliati che impediscono la produzione di una proteina. La tecnica dell’“exon skipping” (salto dell’esone) ha quindi lo scopo di eliminare l’esone che contiene il segnale di STOP errato e di consentire la produzione della proteina.
In conclusione, negli ultimi anni sono stati fatti progressi enormi nella ricerca di una cura per la distrofia muscolare di Duchenne (aprendo la strada a possibili strategie per altre malattie simili) attirando anche l’interesse dell’industria farmaceutica che fino a poco tempo fa non era interessata ad investire in questo tipo di ricerca. Senza dubbio ancora tanto lavoro rimane da fare, ma se una cura definitiva ancora sembra lontana, le terapie che si stanno testando oggi nell’uomo hanno almeno la potenzialità di migliorare la qualità della vita dei pazienti affetti da distrofia muscolare attenuando i sintomi della malattia.
Autore: Alessandra Castiglioni
Alessandra Castiglioni è nata nel 1984 a Busto Arsizio in provincia di Varese. Ha studiato biotecnologie mediche e ottenuto il dottorato in Medicina Molecolare all’Università Vita-Salute San Raffaele a Milano. Qui ha sviluppato la sua curiosità verso il sistema immunitario e il suo coinvolgimento nel rimodellamento tissutale. Da tre anni si è trasferita negli Stati Uniti e attualmente lavora come Post-Doc nel laboratorio di Amy Wagers presso l’Università di Harvard, Cambridge. Ad Harvard continua a studiare il processo di rigenerazione muscolare focalizzandosi sulle cellule staminali del muscolo e la loro interazione con il sistema immunitario, convinta che quest’interazione giochi un ruolo fondamentale nella patofisiologia del muscolo.